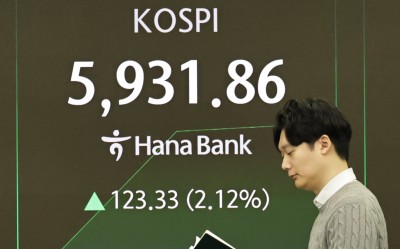
[서울=뉴스핌] 서영욱 기자 = GC녹십자가 미국 면역글로불린 시장 진출을 타진한다.
GC녹십자는 면역글로불린 제제인 'GC5107(제품명: 아이비글로불린에스엔주 10%)'에 대한 품목허가 신청서(BLA)를 미국 식품의약국(FDA)에 제출했다고 26일 밝혔다.
국내 혈액제제 중 글로벌 상업화를 앞둔 것은 이번이 처음이다.
FDA 품목 허가 신청 절차는 일반적으로 60일 간 예비심사를 통해 제출된 자료의 수용 여부가 검토되며, 이후 통상 10개월 내 최종 품목 허가 승인 여부가 결정된다.
 |
GC녹십자는 지난해 'GC5107'의 북미 임상 3상을 마무리했다. '일차 면역결핍증(Primary Humoral Immunodeficiency)' 환자를 대상으로 한 임상에서 FDA 가이드라인에 준한 유효성 및 안전성 평가 변수를 만족시켰다.
유효성 측면에서 'GC5107'을 투약해 12개월 간 '급성 및 중증 세균성 감염(Acute Serious Bacterial Infections)' 빈도를 측정한 결과, FDA 기준인 1보다 낮은 0.02의 수치를 나타냈다.
안전성 평가에서도 약물로 인한 사망이나 심각한 수준의 이상반응이 관찰되지 않는 등 모든 기준을 충족시키는 결과를 보였다.
미국 면역글로불린 시장은 약 81억 달러 규모다. 최근 자가면역질환의 증가로 면역글로불린에 대한 수요는 지속적으로 증가하는 추세이다.
하지만 대규모 설비 투자와 고도화된 생산 경험이 필수적인 혈액제제는 세계적으로 생산자가 매우 제한적으로, 공급 부족 현상이 자주 발생하는 것으로 알려져 있다.
미국은 세계에서 가장 큰 면역글로불린 시장 규모를 형성하고 있으며, 면역글로불린의 미국 시장 가격은 국내보다 4배 정도 높게 형성되어 있다.
허은철 GC녹십자 사장은 "이번 BLA 제출은 자국 바이오 의약품 사업의 미국 시장 진출이라는 목표를 향한 큰 도약을 의미한다"며 "세계 시장에서 이미 인정받은 제품력을 기반으로 미국 내 의료진과 환자들에게 의미 있는 치료 옵션을 제공하겠다"고 말했다.
syu@newspim.com