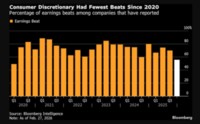
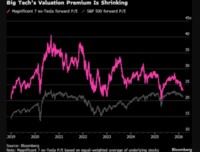
[서울=뉴스핌] 배요한 기자 = 항체 바이오의약품 전문 제약회사 프레스티지바이오파마는 지난 7월 말 유럽 의약품청(EMA)에 신청한 허셉틴 바이오시밀러 'HD201'의 판매허가 신청(MAA)이 심사 절차에 돌입했다는 연락을 받았다고 22일 밝혔다.
유럽의약품청은 레터를 통해 회사가 제출한 서류가 심사에 충분하다는 확인과 함께 향후 구체적인 심사 일정을 통보했다. 회사는 첫 바이오시밀러 제품의 품목 허가 획득에 자신감을 가지고, 제품 판매를 위한 생산전담 계열사인 프레스티지바이오로직스의 막바지 가동 준비에도 더욱 박차를 가하기로 했다.
프레스티지바이오파마는 허셉틴 바이오시밀러 'HD201'의 허가 심사 절차 돌입으로 첫 상용화 제품 출시에 대한 준비를 더욱 철저하게 진행하고 있다. 계열회사 프레스티지바이오로직스가 생산을 전담하면 원스톱솔루션의 원가경쟁력을 바탕으로 충분한 경쟁력을 갖출 수 있다는 설명이다. 이미 각 대륙별로 유수의 글로벌 빅파마들과 판매 계약이 완료되었으며, 지난 6월 참가한 바이오USA에서 만난 다수의 파트너사들과도 긴밀한 판매 협의를 진행하고 있다.
프레스티지바이오파마 관계자는 "첫 상용화 제품 출시를 통해 기업의 수익성을 실현하고 의약품의 전주기를 통합하는 풀밸류체인을 갖춘 그룹사의 시너지 효과를 극대화시키기 위해 최선을 다하고 있다"며, "가장 큰 기대를 받은 주력파이프라인 'HD201'의 조속한 유럽 허가 획득을 통해 약속을 지키는 기업의 핵심가치를 증명할 것"이라고 말했다.

yohan@newspim.com