[서울=뉴스핌] 박다영 기자 = 지난 1월 28일부터 2월 28일까지 42개 업체가 신종 코로나바이러스 감염증(코로나19) 진단시약 총 64개에 대해 식품의약품안전처에 긴급사용승인을 신청한 것으로 확인됐다.
식품의약품안전처는 이중 19건을 검토 완료했다. 코젠바이오텍, 씨젠, 솔젠트, 에스디바이오센서가 신청한 4건은 긴급사용 승인을 받았고 6건은 성능 미흡으로 부적합 판정을 받았다. 1건은 임상성능평가가 불가능했으며 8건은 업체가 신청을 취하했다.

이밖에 식약처는 45건을 검토하고 있으며 8건은 질병관리본부에서 임상성능평가를 앞두고 있다. 8건은 식약처 검토결과 평가자료를 보완하고 있으며 29건은 서류 검토 단계에 있다.
긴급사용 승인제도는 감염병 대유행이 우려되는 상황에서 진단시약 등 국내에서 허가받은 의료기기가 없거나 공급이 부족한 경우 중앙행정기관이 요청한 제품의 허가를 면제해 한시적으로 제조(수입), 판매, 사용할 수 있게 하는 제도다.
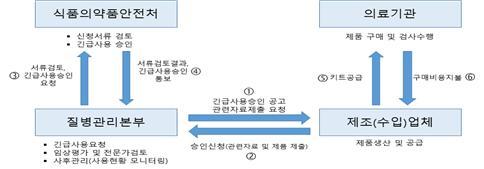
식약처는 ▲서류검토(식약처) ▲임상성능평가(질본) ▲전문가 검토(대한진단검사의학회) ▲승인요청(질본) 및 승인(식약처) 등 4단계 검토절차를 거쳐 승인하고 있다.
현재 긴급사용 승인된 코로나19 진단시약 4개 제품은 모두 국내 의료기기 제조업체에서 생산되고 있다. 지난 9일 기준 1만5971키트(52만2770명 분량)이 생산됐다. 이중 1만1478키트(38만1500명 분량)이 공급됐고 4493키트(14만1270명 분량)은 업체에서 재고로 보유중이다.
allzero@newspim.com