"국산 경구용 치료제, 임상 3상 결과 보고 판단할 것"
[세종=뉴스핌] 김경민 기자 = 식품의약품안전처(식약처)가 미국 제약사 머크앤드컴퍼니(MSD)의 '먹는 신종 코로나바이러스 감염증(코로나19) 치료제'에 대한 긴급 사용 승인 절차에 착수했다. 이르면 연내에 MSD 경구용 코로나19 치료제에 대한 승인이 날 것으로 예상된다.
식약처는 또 미국 제약사 화이자의 경구용 코로나19 치료제에 대한 사전 검토도 진행 중이다.
김강립 식약처장은 취임 1주년을 맞아 17일 충북 오송에서 진행된 출입기자 간담회에서 "질병관리청에 의해 MSD의 경구용 치료제의 긴급 사용 승인이 신청됐다"라고 말했다.
또 "안전성과 효과성 등 기본적인 자료를 검토하고 긴급 사용 승인 여부를 결정하겠다"며 "전문가 자문 등의 절차 밟아서 긴급 사용 승인 위원회의 결정을 보고 최종 판단 하려고 한다"고도 했다.
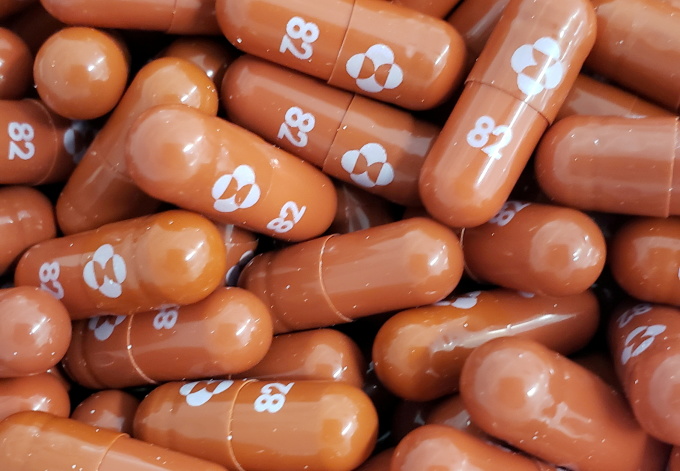
식약처가 승인 절차에 착수한 MSD의 코로나19 치료제는 '라게브리오(성분명 몰누피라비르)'다. 라게브리오는 리보핵산(RNA) 유사체로, 바이러스 복제 과정에서 필요한 정상적인 리보핵산 대신 삽입돼 바이러스 사멸을 유도한다.
식약처는 제출된 임상, 품질자료 등을 면밀하게 검토하고 전문가 자문회의와 '공중보건 위기대응 의료제품 안전관리·공급위원회' 심의를 거쳐 제품의 안전성과 효과성을 확인한 후 긴급 사용 승인 여부를 결정할 예정이다.
식약처는 빠르면 연내에도 라게브리오 승인이 가능하다고 판단하고 있다.
김 처장은 "긴급 사용 승인에 대해서는 언제까지 해야 된다는 법령상 규정은 없으나 최대한 자문이나 필요한 위원회의 심의 절차를 밟고 긍정적인 결과가 나온다면 충분히 연내 안에 진행될 것"이라며 "먹을 수 있는 방식의 의약품이 치료 현장에서 사용되기 시작된다면 방역당국에서 다양하고 상황에 맞는 전략을 구사할 것으로 예상한다"고 설명했다.

아울러 식약처는 지난 10일부터 화이자의 '팍스로비드'에 대한 품목허가 신청 전 사전 검토도 하고 있다. 식약처는 이 과정을 통해 품질과 비임상 자료를 들여다 볼 예정이다.
화이자의 팍스로비드는 바이러스 복제에 필수적인 단백질 분해효소(3CL 프로테아제)를 저해해 코로나19 바이러스 증식을 억제한다.
이에 대해 김 처장은 "화이자의 경구용 치료제는 아직 긴급 사용 승인 신청이 들어오진 않았으나 일정 부분 자료를 요청해 사전 검토를 진행하고 있다"며 "질병관리청의 요청이나 회사가 직접 허가 신청이 있다면 최대한 철저하고 신속하게 심사 절차를 진행하겠다"고 했다.
특히 국산 코로나19 경구용 치료제에 대해서 김 처장은 "효과성에 있어서는 임상 3상 진행 없이 조건부 허가를 요구할 수 있는 수준의 제품을 아직 발견하지 못 했다"며 "다만 임상 3상 시험을 통해 일부 확인된 효과를 좀 더 검증해볼 만한 가치가 있다고 판단해서 임상 3상 결과를 보고 최종 판단하겠다"고 했다.
kmkim@newspim.com