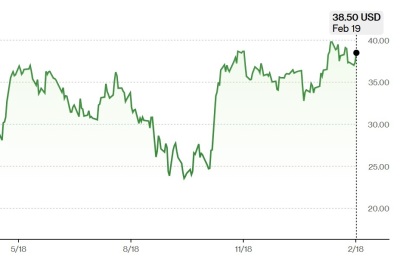
[서울=뉴스핌] 이나영 기자= 마이크로바이옴 신약 개발 전문기업 고바이오랩이 궤양성 대장염 치료제 파이프라인인 KBLP-007(후보물질 KBL697)의 임상 2상 시험 지역에 한국을 포함하는 임상시험계획(IND)을 식품의약품안전처로부터 승인받았다고 24일 밝혔다.
KBL697은 뛰어난 안전성 및 내약성이 검증된 고기능성 생균치료제 개발 후보다. 고바이오랩은 KBL697를 활용하여 건선을 타깃하는 KBLP-001 및 궤양성 대장염을 타깃하는 파이프라인 KBLP-007을 개발하고 있다. KBLP-007은 현재 미국 FDA로부터 임상 2a상을 승인받아 호주에서 환자모집을 진행하고 있다.

고바이오랩은 2022년 9월, KBLP-007 임상 진행을 위해 한국 지역을 추가하는 내용의 IND를 식품의약품안전처에 제출한 바 있다. 이는 2022년 4월 식품의약품안전처가 '생균치료제 임상시험 시 품질 가이드라인'을 새롭게 마련함에 따라, 인체 마이크로바이옴 기반 생균치료제의 국내 임상에 대한 제도적 기반이 갖추어진 점을 고려한 결정이다.
고바이오랩 관계자는 "본 승인은 향후 마이크로바이옴 치료제의 국내 임상이 본격적으로 진행될 수 있는 중요한 근거가 될 것" 이라며 "향후 마이크로바이옴 치료제 개발에 앞장설 계획이다"고 전했다.
nylee54@newspim.com