"임상 관문 넘겨", 대법원 판단 변수
[서울=뉴스핌] 김신영 기자 = 인보사로 알려진 코오롱티슈진의 골관절염 세포 유전자 치료제가 미국에서 임상 3상을 마치고 미국식품의약국(FDA) 품목 허가 절차를 남겨두고 있다.
국내에서 퇴출당한 인보사가 명예를 회복할 것이란 기대가 모이는 가운데, 식품의약품안전처 품목 허가 취소 여파로 수년째 이어지고 있는 법적 공방에 영향을 미칠지 주목된다.
12일 코오롱티슈진에 따르면 회사는 지난 10일(미국 현지시간) 골관절염 세포유전자 치료제 TG-C(한국 출시명 인보사케이주)의 FDA 허가를 위한 무릎 임상 3상 투약을 성공적으로 마쳤다. 앞으로 추적 관찰을 위해 2년간 1000명 넘는 환자가 병원에 주기적으로 방문해 검진을 받는다. 해당 결과가 임상 데이터로 쌓이면 품목 허가 절차를 밟을 계획이다.
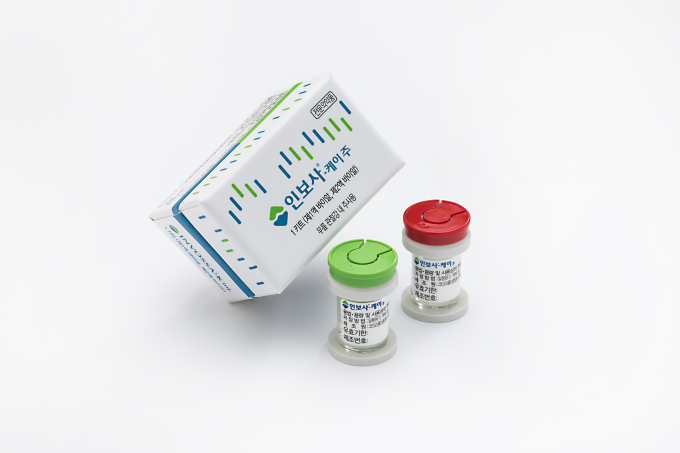
코오롱티슈진은 2006년 인보사의 미국 진출을 목표로 임상 1상에 착수한 후 2010년 2상, 2014년 3상에 진입했다. 국내에서도 세계 최초 골관절염 세포 유전자 치료제로 관심을 받은 인보사는 2017년 식약처 허가를 받았다.
하지만 인보사 허가 당시 원료가 되는 2액 세포에 대해 '형질 전환 연골유래 세포'로 품목 허가를 받은 것과 달리, 종양 유발 위험이 있는 '태아 신장 유래 세포'였던 사실이 드러나 2019년 품목 허가가 취소됐다. 코오롱티슈진도 미국 임상 3상 진행 중 세포기원 착오에 대해 FDA에 보고하면서 임상보류 결정이 났으나, 소명 절차를 거쳐 2021년 재개됐다.
인보사의 국내 판권을 가진 코오롱티슈진의 모회사인 코오롱생명과학은 식약처를 상대로 품목 허가 취소 처분 취소소송을 제기했으나, 재판부는 1·2심 모두 식약처의 손을 들어줬다.
대법원은 지난 5월 사건을 재판부에 배당하고 상고 이유와 법리 검토를 개시했다. 그 사이 코오롱티슈진의 미국 임상이 마무리되면서 향후 임상 결과와 품목 허가 여부 등이 재판에 영향을 미칠 수 있다는 관측이 나온다.
업계 한 관계자는 "인보사가 미국에서 글로벌 의약품으로 부활하면 국내에서도 재기할 가능성이 있다"며 "식약처와 진행 중인 재판 결과에도 영향을 미치지 않을까 싶다"고 전했다.
반면 법조계는 미국에서의 임상 결과 등이 재판을 뒤집을 만한 직접적인 증거가 되긴 어렵다고 전망했다.
양태정 법무법인 광야 변호사는 "임상 결과 등이 없는 것보다는 낫겠지만, 미국에서 임상이 잘 마무리 됐다는 사실 자체가 행정소송에 직접적인 증거가 될 것 같진 않다"며 "대법원 상고는 법률심이라 약물 효능 등을 입증했더라도 증거로 반영되기에는 한계가 있다"고 말했다.
코오롱티슈진 관계자는 "임상 절차에 있어서 어려운 관문은 다 넘긴 상황"이면서도 "향후 국내 품목 허가에 다시 도전하려면 식약처와 별도의 협의 등이 필요한 것으로 알고 있다"고 말했다.
sykim@newspim.com