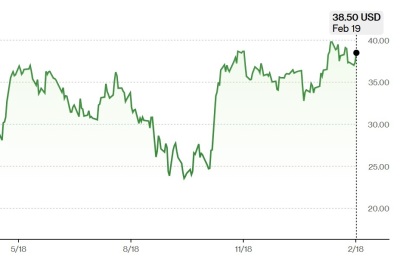
[세종=뉴스핌] 신도경 기자 = 식품의약품안전처가 보툴리눔 독소를 주성분으로 하는 의약품인 보툴리눔 제제의 안전한 개발을 위해 간담회를 개최했다.
식약처는 최근 국내에서 활발하게 개발되는 보툴리눔 제제의 독성 평가를 수행하는 비임상 수행기관과 간담회를 개최한다고 22일 밝혔다.
보툴리눔 제제는 혐기성 세균인 보툴리눔 균에 의해 만들어지는 신경독 단백질인 보툴리눔 독소가 주성분인 의약품이다. 국내 제조 보툴리눔 제제 허가 품목 수는 2019년 18개, 2021년 32개, 2024년 6월 43개로 증가하고 있다.
간담회에선 최근 개정한 '보툴리눔 제제 심사 시 고려 사항' 중 비임상시험 분야 변경 내용이 비임상시험 기관에 공유될 예정이다. 식약처는 독성이 나타나지 않는 최대용량 평가 시 약리적 효과로만 설명하기 어려운 체중 변화 등을 종합적으로 고려하도록 권고한 바 있다.
아울러 식약처는 독성시험 결과 평가 시 고려 사항 등에 대해 논의할 계획이다. 보툴리눔 제제 비임상시험 시험기관의 애로사항 등도 청취한다.
식약처는 "이번 간담회가 보툴리눔 제제 특성을 고려한 독성 평가 기준을 제시함으로써 비임상시험 결과의 신뢰성을 확보하는 데 도움을 줄 것"이라며 "업계, 시험기관 등과 적극 소통하며 국내 보툴리눔 제제 개발을 적극 지원하겠다"고 강조했다.
sdk1991@newspim.com