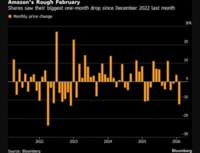
[서울=뉴스핌] 황선중 기자 = 앤디포스는 신종 코로나바이러스 감염증(코로나19) 분자 진단키트 'ND COVID-19'가 식약처 수출허가 승인을 획득했다고 2일 밝혔다.
앤디포스의 진단키트는 신종 코로나바이러스의 특정 유전자(RdRp, E)를 증폭하는 실시간 역전사 중합연쇄반응(Real-time RT-PCR)방식으로 코로나19 감염여부를 2시간 내에 확인할 수 있어 정확하고 신속하게 대량검사가 가능하다.
앤디포스는 코로나19 양성과 음성 검체를 확보해 진단키트 임상시험을 진행한 결과 99.9%의 민감도와 특이도를 나타낼 정도의 타당성을 인정받아 수출허가를 획득했다. 코로나19 진단키트의 국제적 요구가 높아지고 있는 가운데 기술력을 인정받아 수출 허가에 이어 유럽인증(CE)을 진행해 글로벌 진출을 본격화할 전망이다.
앤디포스는 국제표준화기구(ISO)가 제정한 국제 표준규격을 적용해 지난달 'ND COVID-19 Detection Kit'를 자체개발 완료했다. 우수의약품 및 품질관리기준(KGMP)을 승인 받아 올해 말까지 생산 가능한 원재료를 확보해 코로나19 팬데믹을 통해 부각된 진단키트에 대한 시장 수요에 대응할 수 있는 시스템을 구축했다.
회사 관계자는 "해외로부터 분자 및 면역 진단키트에 대해 많은 수출요구 의뢰를 받고 있다"며 "분자와 면역 두가지 제품군을 모두 보유하고 있어 면역 진단키트 수출허가가 완료 후 주요국에 빠른 시일 내에 공급할 계획"이라고 말했다.
이어, "향후 장기화될 가능성이 높은 코로나19 및 신종 바이러스 출현에 발빠르게 대응할 계획"이라며 "보유한 해외 네트워크를 통해 진단키트 관련 문의가 있어 현재 아시아 및 유럽지역 파트너사와 수출계약을 논의 중"이라고 덧붙였다.
한편, 앤디포스는 이번 수출허가를 받은 분자 진단키트 외 10분내로 코로나19 감염여부를 확인할 수 있는 신속진단키트 개발을 완료해 식약처에서 수출허가를 진행중이다.
sunjay@newspim.com